- Определение пострыночного надзора
- Пострыночный надзор: цели
- отсрочек
- Постмаркетинговое клиническое наблюдение (PMCF)
- зоркость
- надзор за рынком
- вывод
- a) Директива о медицинских приборах (MDD, 93/42 / EEC)
- б) Постановление о медицинских приборах (MDR)
- c) ISO 13485: 2016
- d) ISO 14971: 2012
- e) MEDDEV 2.12-1 и MEDDEV 2.12-2
- е) MPG, MPSV
- g) США / FDA: 21 CFR, часть 822, и руководящий документ «Надзор за рынком»
- вывод
- Процедура постмаркетингового наблюдения
Понедельник 10 сентября 2018 Постмаркетинговый надзор
- это упреждающий и систематический процесс сбора информации о медицинских устройствах, которые уже были размещены на рынке. Корректирующие и предупреждающие действия (CAPA, корректирующие и предупреждающие действия) выведем.
Стандарты ISO 13485: 2016 и ISO 14971: 2012 требуют постпродажного надзора, и FDA пересмотрело его в мае 2016 года. Руководящий документ будет опубликован.
Обновление: разделение последующего надзора за рынком на последующее клиническое последующее наблюдение и бдительность.
Определение пострыночного надзора
Как в Регламенте по медицинским приборам (MDR), так и в FDA определен термин «пострыночный надзор»:
Определение: пост-маркетинговый надзор
Размещены на рынке, сделаны доступными или введены в эксплуатацию с целью выявления необходимо немедленно применить любые необходимые коррективы или превентивные меры »
Определение FDA сопоставимо:
Определение: почтовый надзор
«Активный, систематический, научно обоснованный сбор, анализ и интерпретация данных или другой информации о продаваемом устройстве».
Хотя определение FDA приятно короткое, более громоздкое чтение MDR кажется более полезным. Потому что он описывает не только деятельность, но и цели деятельности после рынка.
Пострыночный надзор: цели
Производители должны минимизировать риски, связанные с их медицинскими устройствами, и обеспечить безопасность пациентов перед запуском своей продукции. Власти и Уполномоченные органы отметьте это как часть разрешения или оценка соответствия ,
Однако некоторые риски возникают позже, когда пользователи используют продукты ежедневно.
Пост-маркетинговый надзор направлен на
- систематически выявлять эти риски при практическом использовании продукта,
- проверить работоспособность продукции «в поле»,
- Найдите недостатки продукта и необнаруженные проблемы безопасности
- постоянно обновлять оценку риска и выгоды и
- быстро начать необходимые меры, такие как обратные вызовы.
Только благодаря постоянному пост-маркетинговому надзору производители могут гарантировать, что медицинские приборы обеспечивают обещанные преимущества для пациентов и что не существует неконтролируемых рисков.
Какие данные вы можете рассмотреть в пост-маркетинговом надзоре, читайте ниже.
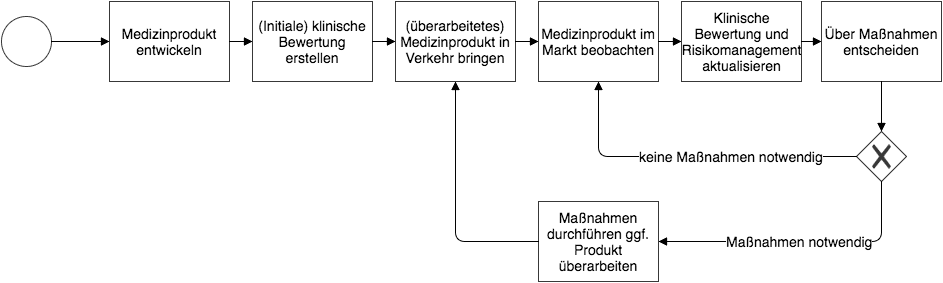
Пострыночный надзор - это непрерывный процесс: сбор и оценка информации, принятие мер и реализация необходимых мер. (Нажмите, чтобы увеличить)
отсрочек
С пост-рыночным надзором тесно связаны термины «пост-маркетинговое последующее наблюдение» (PMCF) и бдительность.
Постмаркетинговое клиническое наблюдение (PMCF)
Как было только что объяснено, пострыночный надзор направлен на постоянную демонстрацию преимуществ медицинских устройств путем наблюдения и анализа повседневного практического использования и выявления ранее неизвестных рисков. Если «нормальное наблюдение за рынком» не дает достаточных данных для этого, могут потребоваться последующие клинические последующие действия производителя, которые также могут включать исследования.
Если PMS станет известно о какой-либо информации, которая может привести к изменению клинической оценки, ее следует обновить. Исследования PMCF предназначены для сбора клинических данных с непосредственной целью клиническая оценка обновить и улучшить.
Определение: постмаркетинговое клиническое наблюдение (PMCF)
«Непрерывный процесс обновления клинической оценки, упомянутой в Статье 49 и Части А настоящего Приложения [XIII]»
Поэтому постмаркетинговое клиническое наблюдение (PMCF) - это систематический сбор клинических данных с целью ответа на открытые важные вопросы о безопасности или работе медицинского устройства. Надзор за рынком включает в себя сбор всех видов важной информации с мест, включая отчеты об услугах, звонки на горячую линию, жалобы клиентов и т. Д.
Целью PMCF является обновление клинической оценки. Цель пострыночного надзора - принять решение о необходимых мерах по обеспечению безопасности пациентов и пользователей. Это решение включает в себя результаты клинической оценки. Таким образом, PMCF является подмножеством пострыночного надзора.
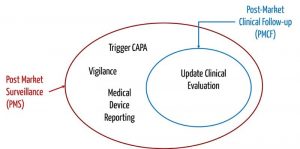
Пост-маркетинговое наблюдение - это избыток послепродажного клинического наблюдения (нажмите, чтобы увеличить)
MDR рассматривает последующее клиническое наблюдение как часть пострыночного надзора. Она пишет, например,
План послепродажного надзора, включая последующее клиническое наблюдение
Тем не менее, FDA не разделяет эти два аспекта так точно: требуется, чтобы план послепродажного надзора содержал информацию, указанную в клинических испытаниях, такую как число субъектов, цель исследования и информированное согласие.
зоркость
Система бдительности - это система реагирующей отчетности . Это означает, что производители должны регулировать, как они сообщают об инцидентах в компетентные органы в рамках бдительности. Законы и нормативные акты, такие как MPSV, дают производителям мало возможностей для определения системы отчетности.
Дополнительная информация
Подробнее об этой теме читайте здесь зоркость который также касается демаркации пострыночного надзора.
надзор за рынком
Не следует путать с «наблюдением за рынком» является «надзор за рынком». Последнее является задачей властей.
вывод
Послепродажный надзор, пострыночный надзор, отчетность, последующее наблюдение за рынком и мероприятия по бдительности частично совпадают. Поэтому термины часто используются взаимозаменяемо, но это не так.
Нормативные требования обычно касаются нескольких аспектов.
a) Директива о медицинских приборах (MDD, 93/42 / EEC)
Директива о медицинском оборудовании (MDD) звонки прямо (Приложение IX, клиническая оценка): производители нуждаются в клиническая оценка обновить данные пост-маркетингового наблюдения. Они должны обосновать, если они не предусматривают последующее клиническое наблюдение во время этого процесса.
б) Постановление о медицинских приборах (MDR)
Медицинское оборудование Регулирование MDR Описывает требования к пост-маркетинговому надзору во много раз более подробно и конкретно. Есть четыре статьи и приложение, посвященное этой теме.
Важными требованиями MDR к надзору за рынком являются:
- Определить, спланировать и поддерживать процесс надзора за рынком
- Сбор и оценка данных постоянно и систематически
- Постоянно на основании этих данных о мерах решить, как
- Начать CAPA (который может повлиять на продукт, а также на производителя и его процессы)
- Информировать власти или пользователей
- Инициировать обратный звонок
- Обновить клиническую оценку
- Отчет о результатах (периодическое обновление отчета о безопасности)
Приложение III регулирует, какие источники следует анализировать и как их следует оценивать.
Наш видео-тренинг «Аудитгарант» представляет требования MDR в понятной форме и дает конкретные советы по внедрению.
c) ISO 13485: 2016
ISO 13485: 2016 обязывает производителей обеспечивать эффективность системы контроля качества и безопасность медицинских изделий, в том числе посредством систематического пострыночного надзора.
d) ISO 14971: 2012
Стандарт управления рисками также содержит требования для «последующей фазы». Однако в центре внимания этого стандарта не система отчетности. Скорее, речь идет о том, чтобы узнать больше о том, поступает ли информация от производства или после нее (например, от использования продукта).
- Вероятности и серьезность возможного ущерба правильно оценены,
- риски полностью определены
- принятые критерии приемлемости риска и соотношения выгоды / риска являются действительными.
На последующем этапе производителям, действующим в соответствии с ISO 14971, нужно не просто искать проблемы. Вся информация, которая помогает проверить или фальсифицировать правильность собственных предположений, имеет большое значение.
Данные, которые вы можете принять во внимание после наблюдения за рынком, описаны ниже.
Отчет об управлении рисками должен подтвердить, что запланированные мероприятия соответствуют требованиям.
e) MEDDEV 2.12-1 и MEDDEV 2.12-2
MEDDEV 2.12-1 описывает требования к системе бдительности, особенно когда производители должны сообщать, какие инциденты, в какой форме и как быстро. Прочитайте вот подробная статья о MEDDEV 2.12-1 ,
MEDDEV 2.12-2 дает рекомендации по последующим клиническим последующим исследованиям. Вот как описывает этот сравнительно короткий документ на 14 страницах
- когда PMCF может быть проиндексирован
- что должен содержать план PMCF и
- какую роль играют уполномоченные органы.
Более подробные руководства по проведению клинических испытаний и исследований (не только PMCF) также приведены в ISO 14155.
е) MPG, MPSV
Хотя для MPG и MPSV требуется надзор за рынком, а скорее система отчетности (система бдительности) и отозвания точные требования.
g) США / FDA: 21 CFR, часть 822, и руководящий документ «Надзор за рынком»
FDA регулирует именно в 21 CFR часть 822
- когда необходим пост-маркетинговый надзор
- что производители должны учитывать при планировании постмаркетингового надзора,
- какие документы должны показать производители и
- как быстро производители реагируют в случае возникновения проблем и FDA действует.
16 мая 2016 года FDA опубликовало Руководящий документ специально для 21 CFR, часть 822, который предназначен для оказания дополнительной помощи производителям.
вывод
В отличие от системы отчетности (бдительность), европейские рекомендации по фактическому «постмаркетинговому надзору» не были столь поучительными, вопреки требованиям FDA.
Однако это изменится с новым MDR, который описывает пост-рыночный надзор гораздо более всесторонне, более конкретно и более подробно. Следующие подробные советы помогут вам в реализации.
Процедура постмаркетингового наблюдения
Как производитель медицинских изделий вы должны регулировать свое пост-маркетинговое наблюдение на основе следующих аспектов - например, в соответствующей процедурной инструкции:
- Триггер деятельности
Обычно есть два возможных триггера- На основе времени или временных интервалов (например, раз в три месяца, каждый третий понедельник месяца)
- Причины, связанные с (например, позвонил клиент, появился новый стандарт, было доставлено устройство на 10.000stes)
- СПИСОК ЛИТЕРАТУРЫ
Примеры источников информации:- Отзывы клиентов, включая жалобы клиентов
- отчеты службы
- Результаты в тестах
- Наблюдения за сотрудниками
- Авторитетные базы данных, содержащие сообщения от производителей сопоставимых продуктов, технологий или процедур о проблемах или мерах
- Звонки на горячую линию
- Клиническая литература
- Результаты пострыночных клинических последующих исследований
- Ярмарки и конференции
- деятельность
Действия обычно включают это- Сбор данных
- Оценка данных
- Оцените данные
- Принятие мер (например, обратный вызов, официальное уведомление, CAPA ) или оправдание безделья.
- обязанности
Процедурные инструкции должны также описывать, какие роли отвечают за какую деятельность. Вовлечены, например, консультанты медицинского оборудования, которые безопасность сотрудник , риск-менеджеры, разработка, поддержка, горячая линия, сервис и менеджмент. - Документация и инструменты
Поскольку производители оценивают обширные данные в контексте пост-маркетингового надзора, мы рекомендуем документировать эту информацию с помощью инструментов. Не забудьте проверить эти инструменты. ISO 13485: 2016 призывает к этому.

